〜Page3〜
|
|
|
|
|
1. はじめに
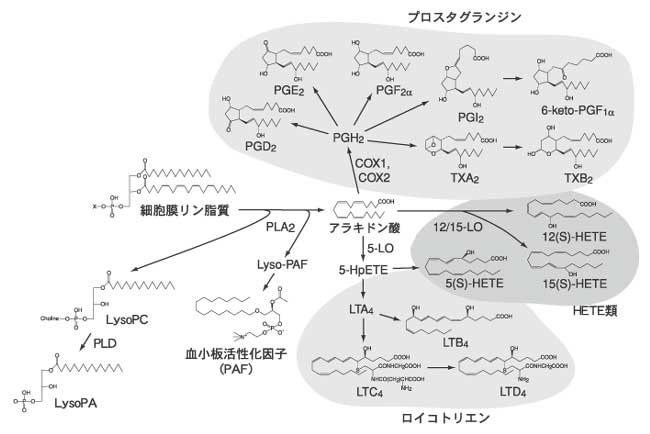
アラキドン酸(20:4、炭素数20で4つの不飽和結合を有する、の意味)から作られる生理活性脂質をエイコサノイドと称する(ラテン語で「20」を意味する「Eicosa」に由来する)。エイコサノイドには、多数のプロスタグランジンやロイコトリエンが含まれる(図1)。
エイコサノイドは脂質に由来し、その生合成には生体内の酵素による触媒反応が必須である。いくつかの酵素については、その阻害薬が臨床医学の現場で用いられている。特にアスピリンに代表される非ステロイド性消炎鎮痛剤(NSAIDs)は、アラキドン酸からプロスタグランジンを産生するのに必須のシクロオキシゲナーゼ(COX)を阻害することで、発熱や痛みの原因物質であるPGE2産生を抑制し、その作用を発揮する。一方で、アラキドン酸に作用する別の酵素である5-リポキシゲナーゼ(5-LO)の働きにより、ロイコトリエンが産生される。
ロイコトリエンは、これから詳細に述べるロイコトリエンB4(LTB4)と、過去にSRS-Aと呼ばれていたペプチドロイコトリエン(LTC4,
LTD4)に大別される。世界に先駆けて日本の小野薬品が開発し、気管支喘息、アレルギー性鼻炎の治療薬として広く用いられているプランルカスト(商品名オノン)は、ペプチドロイコトリエンの受容体であるCysLT1を阻害する薬剤である。本稿では、ペプチドロイコトリエンではなく、LTB4とその受容体であるBLT1、
BLT2について解説する。
|
|
|
|
LTB4の分子同定
1991年に、脂質メディエーターである血小板活性化因子やトロンボキサンの受容体の遺伝子が同定され、いずれも細胞膜に存在する受容体であることが明らかになった。トロンボキサン受容体と類似した構造を有するプロスタグランジンの受容体は、遺伝子工学の手法を用いることで短期間にその全てが遺伝子同定された。
一方、同じアラキドン酸に由来するロイコトリエンの受容体の同定は困難を極めた。一次構造がプロスタグランジンの受容体と大きく異なること、細胞における発現量が少ないこと、が最大の理由であった。私たちは、LTB4受容体が好中球に発現していることと、HL-60と呼ばれる白血球細胞株が好中球に分化可能であることをヒントにして、HL-60を好中球に分化する際に誘導される遺伝子群の中から、LTB4受容体(BLT1)の遺伝子を同定した。BLT1遺伝子の転写調節のメカニズム解析を行っている過程で、全く偶然にBLT1遺伝子の近傍に別のLTB4受容体(BLT2)遺伝子を発見した。
BLT1とBLT2遺伝子はヒト14番染色体に隣接して存在しており、互いの構造も極めてよく似ている。もともとは1つであった遺伝子が、進化の過程で遺伝子重複により二つになり、それぞれが独自の機能を有するため現在まで保存されてきたものと考えられる。BLT1、
BLT2受容体は共に細胞膜を7回貫通するGタンパク質共役型受容体であり、BLT1はnMという低濃度のLTB4で活性化される高親和性受容体、BLT2は活性化に数10-100
nM程度のLTB4を必要とする低親和性の受容体であると考えられている。
LTB4受容体欠損マウスの解析
ある受容体の遺伝子が同定されれば、その分子を欠損したマウスを作成してその表現型を解析するのは現在の基礎医学研究の常道である。我々を含めて世界で3つの研究グループがBLT1を欠損したマウスを作成し、様々な疾患モデルを用いてBLT1欠損の影響を研究している。LTB4はBLT1が同定される以前から、強力な好中球活性化因子として知られており、主として細菌感染時の感染部位に好中球をリクルートすることで細菌の排除を行う因子であると考えられていた。驚いたことに、腹腔に細菌感染を起こした際の感染排除能において、BLT1欠損マウスと野性型マウスとの間に顕著な差は認められなかった。
LTB4が感染排除に関与していないわけではなく、BLT1受容体が欠損しても他のケモカインや補体系の受容体がBLT1の機能を代償し、易感染性とならないようなメカニズムが存在しているものと考えている。その後の様々な病態モデルを用いた解析から、BLT1はいくつかの炎症・アレルギー性疾患において主要な発症因子として機能しているらしいことが分かってきた。
BLT1と気管支喘息
上述したペプチドLT(SRS-A)は強力な気管支平滑筋収縮作用を有することから、その受容体であるCysLT1の拮抗薬が気管支喘息の治療薬として広く用いられている。一方、気管支喘息におけるLTB4の関与は否定的であった。
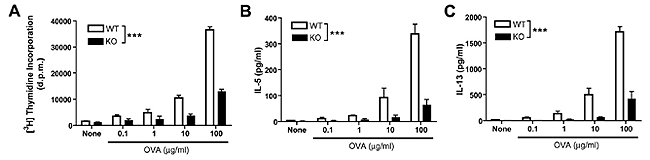
マウスをオボアルブミン(OVA)で感作し、OVAエアロゾルを吸引させることで気管支喘息を引き起こすことができる。BLT1を欠損したマウスはこのモデルにおいてメサコリンに対する気道過敏性が生じないことが分かった。気管支喘息を引き起こした野性型マウスでは、肺胞洗浄液中に多数の好酸球の浸潤が観察されるが、BLT1欠損マウスでは気道への好酸球浸潤がほぼ完全に抑制されていたのに加えて、PAS染色陽性の坏細胞の形成も減弱していた。OVAに対するIgGのタイターは正常に上昇していたが、IgEへのクラススイッチが欠損しており、Th2型免疫反応の減弱が予想された。
気管支周囲のリンパ節細胞をOVAで再刺激した際のT細胞の増殖や、IL-5、
13といったサイトカイン産生もBLT1欠損マウスでは抑制されており(図2)、LTB4がBLT1を介してTh2型の免疫反応の促進因子として機能していることが明らかとなった。さらに様々なT細胞サブセットを移植するモデルを用いることで、LTB4がCD8陽性のエフェクター細胞が気道内や傍気道リンパ節に浸潤させることでTh2型免疫反応を促進していることが明らかになった。
|
|
|
BLT1と動脈硬化
動脈硬化が炎症性疾患だと捉えられるようになって久しい。ApoEと呼ばれる過酸化脂質受容体を欠損したマウスは、高脂血症を呈し動脈硬化を自然発症する。このマウスとBLT1欠損マウスを交配することで、ApoEとBLT1の両者を欠損したマウスを作出し、ApoE単独欠損マウスと比較することで、BLT1の動脈硬化発症における役割を探った。
動脈硬化巣の面積は、BLT1欠損マウスで約半分となったことから、LTB4がBLT1を介して動脈硬化の増悪因子として機能していることが分かった。動脈硬化巣周辺の炎症が軽減しており、特に単球とリンパ球の浸潤の低下が著明であった。ヒト単球にLTB4を作用させると、NF-kBの活性化に引き続き、単球走化性因子であるMCP-1タンパク質の発現が生じることから、LTB4はMCP-1の産生亢進を介して動脈硬化を進行させていることが示唆された。
BLT1と樹状細胞
マウスを用いたin
vivoの実験によって、BLT1欠損マウスの免疫異常(免疫反応の減弱)には、T細胞以外に樹状細胞の機能異常も関与していることが分かってきた。抗原提示細胞の中で最も強力であると考えられている樹状細胞にはBLT1が発現しており、LTB4添加によって細胞内カルシウム上昇や細胞の走化性を引き起こす。
皮膚にFITCを塗布し、一定時間後に所属リンパ節内でFITCを食べ込んだ樹状細胞の数を測定すると、BLT1欠損マウスでは、樹状細胞のリンパ節への移動に障害があることが分かった。樹状細胞機能を観察する遅延型過敏反応がBLT1欠損マウスでは減弱していたことから、LTB4は抗原の貪食とリンパ節への移動、あるいは抗原提示能を上昇させることによって免疫反応を促進しているらしいことが明らかとなった。
おわりに
古典的な炎症性メディエーターであるLTB4は、受容体であるBLT1、BLT2が同定され、それぞれの遺伝子欠損マウスの解析によって、免疫反応を調節する重要な因子であることが明らかになってきた。免疫反応とLTB4の関連が注目されてこなかった最大の理由は、抗原に暴露されていないナイーブなT細胞にLTB4受容体が発現していないことにある。事実、ナイーブなT細胞を
in vitroでTh1あるいはTh2型に分化させると、BLT1のmRNA
は強く誘導される。
細菌感染の排除を行うLTB4が、その後の免疫反応の成立にも役割を果たすことは、改めて考えてみると極めて合目的であり、今後、炎症反応から免疫反応をつなぐ因子としてますます研究が進んでいくことが期待される。また、過剰な免疫反応によって引き起こされるアレルギー疾患の治療対象分子としてBLT1は極めて有望であり、現在、多数の製薬会社がBLT1拮抗薬を新規抗アレルギー薬として開発している。また、低親和性LTB4受容体であるBLT2の役割についても今後の研究の進展が期待される。
|
|
|
|
佐賀大学医学部小児科教授 浜崎 雄平 |
はじめに
気道上皮はバリアーとしての機能をはたすのみならず、種々の活性物質を産生することが知られている。小児の気管支喘息の発病並びに増悪の機序に呼吸器感染、特にウイルス感染が大きな役割を果たしていることが近年報告されており、ウイルスの気道上皮への感染時における活性化の機序と喘息症状との関連は興味深い。また、喘息の病態の発現にアラキドン酸5-lipoxygenase代謝物であるcysteinyl
leukotriene(cysLTs)が主要なメディエーターもしくは調節因子として作用していることも明らかとされてきた。
cysLTsに関してはcysLTR1(1型受容体)拮抗薬が治療薬として臨床現場にすでに導入され、乳幼児ではその安全性の面からも広範に使用されている。 我々は培養気道上皮細胞にcysLTR1が発現していることを見いだし報告したが、ウイルス気道感染との関与については明確ではなくさらに検討が必要と考えている。
ウイルスの気道上皮細胞感染による細胞活性化:
 ヒトの気道上皮細胞であるBEAS-2Bと正常ヒト気道上皮細胞NHBEを培養し、合成したpoly
inosinic-cytidyric acid: poly IC
(dsRNA)を加えて一定時間培養しtransfectionを行ない気道上皮細胞に対するウイルス感染のモデルとした。
ヒトの気道上皮細胞であるBEAS-2Bと正常ヒト気道上皮細胞NHBEを培養し、合成したpoly
inosinic-cytidyric acid: poly IC
(dsRNA)を加えて一定時間培養しtransfectionを行ない気道上皮細胞に対するウイルス感染のモデルとした。
poly ICのtransfectionにより気道上皮からのRANTES、
IL-8産生は著明に増強し、eotaxin-3産生も増加したが、poly
ICの刺激のみでは産生量の絶対値はRANTES、
IL-8に比して少ないことが明らかとなった。そこで、アレルギー性サイトカインと考えられているIL-4、
IL-13をBEAS-2B細胞と正常ヒト気道上皮細胞NHBEに加えて培養すると、0。05-50
ng/mlの濃度範囲で、また3-48時間のincubation
timeの範囲で用量依存性、時間依存性にeotaxin-3産生が増強することが判明した。
この産生増加はRT-PCR法を用いた半定量的mRNA測定により転写レベルでのmRNAの誘導に由来すること。また、IL-4とIL-13とを比較するとIL-4の作用がより強力であることも明らかとなった。次に、poly
ICの刺激を24時間行なった上で、IL-4による刺激を追加したところ、IL-4によるeotaxin-3の誘導がさらに2倍以上増強されることが明確となった。
活性化の機序:
さらにその機序を解明するために、IL-4受容体の動態を検討した。IL-4受容体はIL-4Ra鎖とIL-2Rr鎖からなる2量体である。この2分子の細胞表面での発現がpoly
ICのtransfectionにより影響を受けている可能性をflow
cytometry法を用いて検討した。その結果、poly
ICのtransfectionによりIL-4Ra鎖とIL-2Rr鎖はいずれも用量依存性にIL-4受容体分子の発現をup-regulationすることが明らかとなった。
一方、 IL-13のシグナルを細胞内に伝達する受容体はIL-4Ra鎖とIL-13Ra鎖からなる2量体である。poly
IC刺激ではIL-13Ra鎖の発現は影響を受けず、このことがIL-4に比べてIL-13の刺激の増強が弱い原因であると考えられた(1)(2)(3)。
cysLTsのeotaxin-3産生におよぼす影響:
cysLTsは細胞膜を構成する燐脂質のC-2の位置に存在するアラキドン酸が、phospholipase
A2、5-lipoxygenase、LTC4
synthaseにより代謝されて合成される脂質化合物LTC4、 LTD4、
LTE4の混合物で、細胞表面の受容体であるcysLTR1、およびcysLTR2に結合してその活性を発揮する。アレルギーの機序に関連した活性はcysLTR1を介して発現すると考えられている。
我々は、気道上皮細胞にcysLTR1、およびcysLTR2がともに発現していることを確認した。しかるに気道上皮細胞に発現するこれら受容体の生理学的、病理学的意義は現時点では明らかにされていない。そこでcysLTsがIL-4刺激による気道上皮細胞からのeotaxin-3産生に影響をおよぼすかどうかを培養BEAS-2B細胞を用いて検討した。cysLTsのなかで最もその活性が強く、生体内では主要な役割をはたしていると考えられるLTD4で刺激すると、IL-4刺激によるeotaxin-3産生の増強はさらに増強することが確認された。
考察とまとめ:
喘息の小児はリンパ球のTh1/Th2バランスがTh2有意に傾いていると考えられる。したがって、喘息患児の気道局所ではIL-4、
IL-13サイトカインが有意に存在することが推測される。
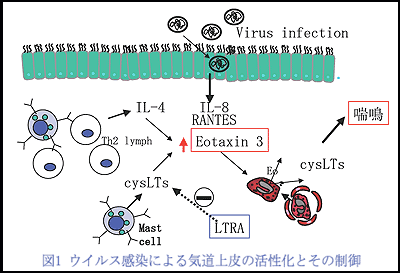
気道上皮にウイルスが感染すると、気道上皮におけるIL-4受容体のmRNAレベルでの誘導が引き起こされ、IL-4による気道上皮からのeotaxin-3産生が増加する。eotaxin-3は好酸球に対する強力な遊走因子であり、気道局所への好酸球浸潤を引き起こし、好酸球性炎症を増強させる。好酸球はcysLTsの産生細胞であり、好酸球から産生されたcysLTsは気道上皮に作用して更にeotaxin-3産生を増強する。これらは喘息患児で気道のウイルス感染が症状の増悪に寄与している機序のひとつであると考えられる。cysLTR1(1型受容体)拮抗薬が乳幼児のウイルス感染時の喘鳴に有効であるとのBisgaadらの報告を支持する所見と考えている。
上記研究は教室の小林育子、辻功介、西奈津子、室英理子、欧維林、在津正文らの協力により行なわれたことを付け加え深謝致します。
|
文献 |
|
|
1) |
Kobayashi I, Yamamoto S, Hamasaki Y, et al. Ann Allergy Asthma Immunol 93: 390, 2004. |
|
2) |
Yamamoto S, Hamasaki Y, et al. Am J Respir Cell Mol Biol 31: 456, 2004 |
|
3) |
Tsuji K, Yamamoto I, Hamasaki Y, et al. Eur Respir J 26: 795, 2005 |
|
|
|
|