
〜Page3〜
|
|
|
|
|
はじめに
気管支喘息は、可逆性の気道狭窄、気道炎症、気道過敏性亢進を主要な特徴とする疾患である。この喘息の病態には、好酸球・肥満細胞・Tリンパ球など種々の細胞浸潤を伴う気道炎症が関与し、気道過敏性亢進や気道リモデリングを引き起こしていると考えられている。
CD4+
T(Th)細胞は、主にIFNγを産生するTh1細胞と、IL-4やIL-5等を産生するTh2細胞のサブセットに分けられる。さらに近年では、実験的自己免疫性/アレルギー性脳脊髄炎の発症に関与するIL-17産生性T(Th17)細胞、免疫反応のコントロールに制御性T細胞(regulatory
T cell; Treg)が存在することが明らかとなっている。
CD4+のTregは、胸腺由来のnaturally occurring Treg
(nTreg;
CD4+CD25+でFoxP+)と、IL-10を高産生するTr1
(T regulatory
1)、TGFβ産生性のTh3が知られている。Th3は、CD4+CD25-から誘導されるFoxP+のinducible
Treg (iTreg)と同じ可能性もある。
アレルギー疾患の発症に、このような調節性T細胞の重要性やCD8+T細胞の関与なども注目されているが、アレルギー性炎症が概ねTh2タイプであることは多くの基礎的、臨床的知見が積み重ねられ疑問の余地はないものと考えられる。すなわち、IL-4/IL-5/IL-9/IL-13などのTh2サイトカインはアレルギー疾患の発症に大きな役割を担っている。
これらのサイトカインは細胞膜上の受容体に結合し、受容体が活性化すると、JAK/STAT系、Ras-Raf/ERK系などのシグナルが働くことにより応答遺伝子発現が制御され、サイトカインが作用する。これまで、細胞内サイトカインシグナルは、主にこのような促進性シグナルについての解析が進められてきた。
しかし、生体には反応を鎮静化するさらに複雑なシグナルの制御機構が存在し、正と負の制御機構間でのクロストークがバランスを巧妙に制御している。このような内因性抑制性の中には、SOCS
(Suppressor of Cytokine Signaling)やSPRED(Sprouty-related
protein with EVH-1 domain)分子がある。
今回、アレルギー性喘息の病態におけるSOCSの役割についての研究結果を解説する。
SOCSとアレルギー性喘息
SOCSファミリーは、これまで8個のSOCS分子(CIS, SOCS1〜SOCS7)が同定されている。これらのSOCS分子は、サイトカインによって誘導され、リン酸化したサイトカイン受容体に結合することにより、あるいはJAKのチロシンキナーゼに結合することによって、サイトカインシグナルを抑制する(図1)。
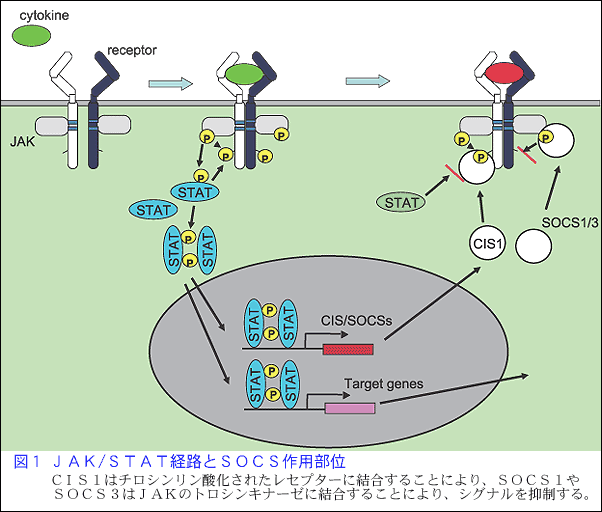
アレルギー性喘息の病態に関与するTh2細胞への分化にはIL-4によるSTAT6の活性化が関与し、一方Th1細胞への分化にはIL-12によるSTAT4及びIFNγによるSTAT1の活性化が関与している。このように、Th1/Th2細胞への分化にはサイトカイン環境が影響していることから、サイトカインシグナル抑制因子であるSOCSがこの分化機構に働いている可能性が考えられた。
そこで、アトピー性喘息患者の末梢血T細胞での各SOCSの発現を解析したところ、SOCS1やSOCS5などは健常者との差異が認められなかったが、SOCS3レベルは喘息患者で高く、重症度が増すにつれSOCS3発現が亢進していた。
さらに、T細胞でのSOCS3発現は、Th2型反応のマーカーでもある血中IgEレベルと相関していた。
そこで、T細胞特異的にSOCS3を過剰発現する(SOCS3
Tg)マウスを用いて喘息モデルを解析したところ、T細胞でのSOCS3高発現は、Th2サイトカインの増加を介して、アレルギー性喘息反応の発症進展に関与していることが明らかとなった。
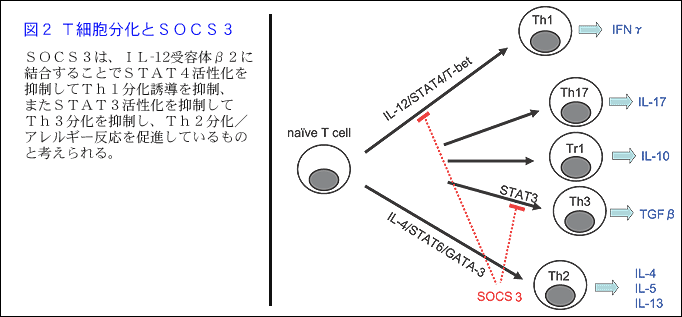
この機序としては、SOCS3はIL-12受容体β2に結合することでSTAT4活性化を抑制しTh1分化誘導を抑制する結果、Th2分化と喘息反応を亢進していると考えられた。
さらに、T細胞でのSOCS3の生理的作用を明らかにするため、T細胞特異的なconditional knockout (cKO)マウスを用いて喘息反応を解析したところ、喘息反応は抑制され、Th2サイトカイン発現亢進も低下していた。しかし、SOCS3-Tgマウスの結果から予想されたIL-12シグナル増強によるIFNγの増加は認められず、IFNγも低下していた。これは、T細胞でSOCS3発現が欠損するとSTAT3がTGFβのプロモーター活性を上げ、Th3分化を亢進させると考えられた。
すなわち、T細胞において、SOCS3が高発現するとTh2分化が促進して喘息を発症・増悪させ、発現が低下するとTh3分化促進により喘息反応が抑制され(図2)、SOCS3の発現や活性を制御することが難治性のアレルギー性疾患や喘息のコントロールに繋がるものと期待された。
おわりに
T細胞において、内因性サイトカインシグナル抑制因子はアレルギー性喘息反応の発症・進展において重要な役割を担っている。さらに、T細胞のみでなく、気道上皮細胞や平滑筋などの気道構築細胞にもサイトカインは作用しており、今後は気道構築細胞でのSOCSの作用機序の解明が必要と考えられる。
|
|
|
|
|
はじめに
小児喘息の発症のピークは1〜2歳で、2歳までに累積約60%が発症している。気道感染の有無にかかわらず、明らかな呼気性喘鳴を3エピソード以上繰り返した場合を乳児喘息と診断する1)。初回喘鳴の場合は、ウイルス感染による急性細気管支炎とその後の喘鳴との異同が課題となっている。
乳児期に喘鳴をきたすウイルス感染症
喘鳴を伴う下気道ウイルス感染症としては、RS( respiratory syncytial )ウイルス(RSV)、ライノウイルス(RV)、パラインフルエンザウイルス(PIV)、ヒトメタニューモウイルス(hMPV)、アデノウイルス、近年新しく発見されたボカウイルスなどが報告されている。
Korppi らは2歳未満のRSV およびRVによる細気管支炎入院児を対象に臨床像を比較した2)。罹患平均月齢はRV 13か月、 RSV 5か月と有意差が認められた。RSVは乳児に多く、RVは6か月以降で多くなる。
乳児期のRSV感染と喘鳴
Simsらは乳児期にRSVによる細気管支炎で入院した群(感染群)と非感染群(対照群)を8年後に調査した。喘鳴/喘息の累積発症率はRSV感染群51%、対照群3%とRSV感染群で有意に高かったと報告した3)。以後同様の報告が相次ぎ、1980年代にはRSV感染が反復性喘鳴のリスク因子であることが立証された。
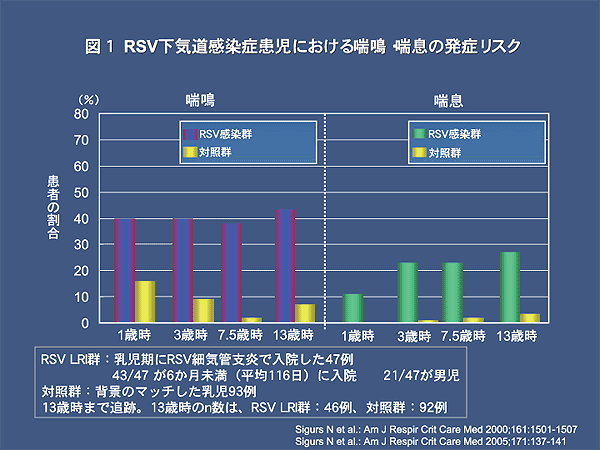
SigursらはRSVによる細気管支炎で入院した乳児(平均116生日)47名(男児21名)と対照群を前向きに調査した。喘息の発症率は3歳時でRSV群23%
に対して対照群1%、7歳半時でRSV群23%に対して対照群2%であった。さらに、同じコホートを13歳まで追跡した結果4)、喘息はRSV群13%であったが対照群は7%であった(図1)。
入院を要したRSV細気管支炎児を対象した報告が多いが、軽症RSV感染児が含まれる報告もある。Steinらは、出生時に登録し前方視的に1246例の予後を調査した5)。
3年間で下気道炎症状を示した症例にはウイルス分離を行い、43.9%にRSVが分離されている。以後13歳まで追跡した結果、RSV感染群(軽症から重症まで)は喘鳴を発症するリスクが有意に高い(Odd比:
3.0)と報告した。その後、11歳までは差が認められるが、13歳では有意差がなくなった。
この報告は、RSV感染が軽症で経過した場合でも喘鳴のリスクが上昇することが示された点で注目される。
RSV感染重症化抑制で、後年の反復性喘鳴を抑制できるか
Simoesらは、「RSVに対するモノクローナル抗体であるpalivizumabによりRSV感染重症化を抑えることが、後年の反復性喘鳴を減少させるか」を検証する目的で、6カ国で国際的多施設共同前方視的症例対照試験を行った6)。在胎35週以下で出生した慢性呼吸器疾患のない早産児を対象として、palivizumab投与群および非投与群に分け、毎月の電話による追跡調査を24か月間行った。
出生体重と在胎期間は非投与群と比較して投与群が有意に少なかった。一方、多胎率、同胞数、デイケアに通う同胞数は有意に非投与群が多かった。
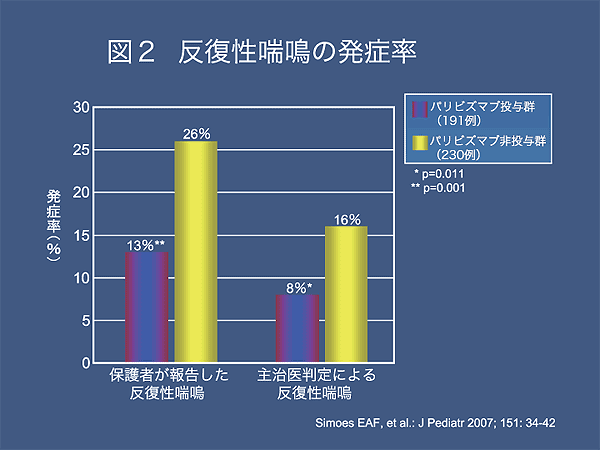
過去12か月以内に3回以上の喘鳴は、palivizumab投与群で25/191(13%)、非投与群は59/230(26%)となり、投与群は非投与群に比較して喘鳴発症率を49%減少した。
医師により過去12か月以内に3回以上の喘鳴が認められた割合も、palivizumab投与群で15/191(8%)、非投与群37/230(16%)となり、投与群は非投与群に比較して喘鳴発症率が51%減少した(図2)。
わが国での調査研究
2002年からわが国では早産児を対象にpalivizumabの投与が開始された。初年度のpalivizumab投与児および非投与児の3歳児健診において、後方視的に生後3年間の咳や喘鳴などに関するアンケート調査を日本未熟児新生児学会、日本小児呼吸器疾患、日本小児アレルギー学会3学会共同で行った。
Palivizumab
投与群の喘鳴2回以上発症の抑制効果は、非投与群と比較して出生体重500〜999g群ではオッズ比0.339(95%信頼区間0.118〜0.980)と有意差が認められた。一方、出生体重1000
〜2499g群では有意な関連はなかった。今後、患者背景をそろえた前方視的調査を反復性喘鳴に関する研究会(Scientific
Committee of Recurrent
Wheezing:SCREW,西間三馨代表世話人)で実施予定である。
|
文献 |
|
|
1) |
日本小児アレルギー学会:乳児喘息の急性発作への対応と長期管理. 小児気管支喘息治療・管理ガイドライン2005(森川昭廣・西間三馨監修) 協和企画 東京p111-132,2005 |
|
2) |
Korppi M, Kotaniemi-Syrjanen A, Waris M et al:Rhinovirus-associated wheezing in infancy comparison with respiratory syncytial virus bronchiolitis. Pediatr Infect Dis J 23:995-999,2004 |
|
3) |
Sims DG et al:Study of 8-year-old children with a history of respiratory syncytial virus bronchiolitis in infancy. Br Med J. 1:11-14,1978. |
|
4) |
Sigurs N et al:Severe respiratory syncytial virus bronchiolitis in infancy and asthma and allergy at age 13. Am J Respr Crit Care Med. 171:137-141,2005. |
|
5) |
Stein RT et al:Respiratory syncytial virus in early life and risk of wheeze and allergy by age 13 years. Lancet 354:541_545,1999 |
|
6) |
Simoes EAF, et al. : Palivizumab prophylaxis, respiratory syncytial virus and subsequent recurrent wheezing. J Pediatr 151 : 34-42, 2007 |
|
|
|
|
